2023胰腺癌学科发展前沿进展
前言 《中国恶性肿瘤学科发展报告》是中国科协指导,由中国抗癌协会权威发布,樊代明院士任总编,数十名院士和1531位肿瘤学专家参与编写。旨在通过梳理肿瘤医学的最新研究现状与进展、肿瘤药物治疗的新方案,从而提患者战胜疾病的信心,为肿瘤治疗信息库的搭建贡献力量。 本期为大家带来的是2023上半年胰腺癌领域重磅研究。在这些研究中既有新突破点的发现,也有对治疗模式的革新与探索,为胰腺癌的诊治研究提供了新的参考。
一、重要临床研究
这次所公布的NAPOLI 3试验是一项随机、开放标签的临床3期试验。共有770位 患者入组,主要终点为OS,次要终点包含PFS、ORR、生活品质、AE等。 数据显示,试验达成主要终点,在中位追踪时间16.1个月期间,接受NALIRIFOX化疗方案患者的OS为11.1个月,显著高于活性对照组(吉西他滨与白蛋白紫杉醇组合疗法)的9.2个月(HR:0.83,95% CI:0.70-0.99,P=0.04);PFS达7.4个月,显著高于接受活性治疗组患者的5.6个月(HR:0.69,95% CI:0.58-0.83,P=0.0001);ORR分别为41.8%(95% CI:36.8-46.9)与36.2%(95% CI:31.4-41.2)。 NALIRIFOX化疗方案的安全性可控,与在之前试验中所观察到个别药物的不良反应特性一致。最常见3/4级治疗伴发不良反应(TEAE)包含:腹泻、恶心、低钾血症、贫血与中性粒细胞减少。
这次公布的试验是一项单臂研究,旨在评估antroquinonol联合标准治疗方案(nab-paclitaxel+gemcitabine)作为IV期转移性胰腺癌一线疗法的安全性和疗效。中期报告显示,接受antroquinonol与标准治疗方案联合疗法的患者获得明显的临床益处。患者的中位无进展生存期(mPFS)为5.3个月,中位总生存期(mOS)为12.6个月,6个月总生存率(OS)为86%,12个月总生存率为60%。 与过去标准治疗方案的3期试验结果相比,antroquinonol联合疗法的中位总生存期、6个月和12个月的总生存率均有显著提高。Antroquinonol联合疗法、标准疗法和gemcitabine单药治疗的总生存期分别为12.6、8.5和6.7个月;6个月总生存率分别为86%、67%和55%;12个月总生存率分别为60%、35%和22%。 现有胰腺癌标准治疗方案经常导致不良事件,从而导致治疗中断。在这项试验中,antroquinonol联合疗法显著减少各个等级的血液相关不良事件,包括中性粒细胞减少症、血小板减少症、贫血和白细胞减少症。对于非血液学不良事件,如疲劳、脱发、周围神经病变和脱水;在接受antroquinonol联合疗法的患者中也有类似的减少。
研究确定,胰腺导管腺癌(PDAC)患者的最佳治疗方法是手术切除原发肿瘤并进行全身化疗,这比单独使用任何一种方法都提供了更长的总生存期(OS)。非转移性胰腺癌的术前评估出现了三个手术阶段:可切除、临界可切除和不可切除。在能够接受辅助化疗(通常为6个月)的可切除胰腺癌患者中,预计5年OS为30-50%。对于临界可切除疾病患者,在手术前增加短期新辅助治疗(通常为2个月)(R0/R1切除率为64-85%)可将12个月OS提高至77%左右,相比之下前期手术占40%(切除率为75%);较长疗程的新辅助化疗(通常为4个月)可使18个月的OS达到67%。 此研究表明,新的新辅助和诱导策略的开发需要整合各种胰腺癌亚组的独特分子和生物学特征,以优化既定和新型治疗方式的选择和排序,改善生存结果。
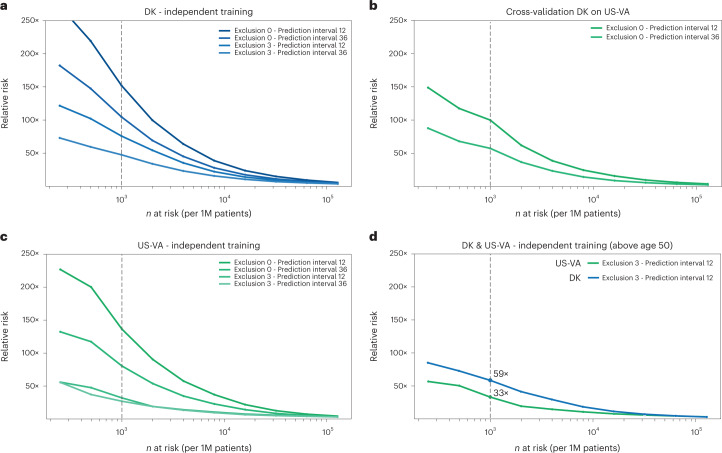
在这项研究中,研究人员将人工智能方法应用于丹麦600万患者(24000例胰腺癌病例)和美国的300万患者(3900例)的临床数据。 研究人员根据临床历史中的疾病代码序列训练了机器学习模型,并测试了对于增量时间窗口内癌症发生的预测。 对于36个月内发生的癌症,最佳DNPR模型的表现为受试者工作特征(AUROC)曲线下面积= 0.88;当排除癌症诊断前3个月内的疾病事件时,其表现降至AUROC(3m)=0.83,对于1000名50岁以上的最高风险患者,其预估的相对风险为59。应用于US-VA的丹麦模型交叉数据表现较差(AUROC = 0.71),需要再次训练才能提高表现(AUROC = 0.78,AUROC(3m)= 0.76)。 这些数据结果提高了为高风险患者设计现实监测方案的能力,人工智能的人群筛查在发现疾病高风险人群方面未来有较大的发展前景。
研究表明,KRAS-TP53基因组共改变与胰腺导管腺癌(PDAC)患者的免疫排斥微环境、化疗耐药性和低生存率有关。通过将KRAS-TP53协同性视为高风险生物学的模型,研究人员通过使用成像质谱细胞术在人PDAC细胞中的CXCR2+中性粒细胞衍生的抑制细胞相互作用,将细胞自主CXCL1确定为空间T细胞限制的关键介质。揭示了癌细胞—中性粒细胞串扰,其中上下文依赖性TNF信号放大基质炎症和免疫耐受,以促进PDAC的治疗耐药性。 第一个涉及未成熟中性粒细胞的免疫抑制信号的研究——发展胰腺癌的最早哨兵。这表明中性粒细胞是这个回路中的主导角色。这是对癌细胞如何与中性粒细胞交谈以及中性粒细胞如何在胰腺肿瘤微环境中这种免疫抑制性炎症戏剧中的主要参与者的首次描述。
TIGeR-PaC试验是一项多中心、开放标签的随机3期临床试验,45名ECOG 0-1 LAPC 患者接受3个周期的白蛋白紫杉醇(GN)和1个周期的放疗(SBRT,33 Gy,分5次)。诱导后,患有非进展性疾病的患者被随机接受动脉内吉西他滨(IAG)(每两周8次治疗,持续16周)或在16周内继续GN 4个周期。经过16周的随机治疗后,疾病未进展的患者根据研究者的偏好接受GN或低剂量口服卡培他滨的持续全身治疗,直至疾病进展,并仅随访生存情况。主要终点是总生存期 (OS)。 接受静脉给药的标准治疗对照组患者的中位总生存期为10个月,而接受动脉内给药的RenovoGem组患者则为16个月。RenovoGem组患者产生不良事件的数量也减少超过65%,对照组与RenovoGem组患者分别产生11(22例患者中)与4起(23例患者中)严重不良事件。 RenovoGem是首个利用RenovoTAMP治疗平台所开发的药物-器械组合候选疗法,已被证实具有安全性,对于临床应用前途光明。
本实验纳入16例胰腺导管癌患者,他们都接受了BioNTech与罗氏子公司基因泰克共同开发的个体化定制mRNA新抗原疫苗Cevumeran和atezolizumab联合治疗。其中15例还接受了后续的mFOLFIRINOX化疗。 新抗原有效率为11%,50%的患者产生有效的T细胞反应。 随访显示,产生反应的患者的有效T细胞应答持续时间超过两年,癌症均未复发且肿瘤转移病灶也被根除了。
二、基础研究重要进展
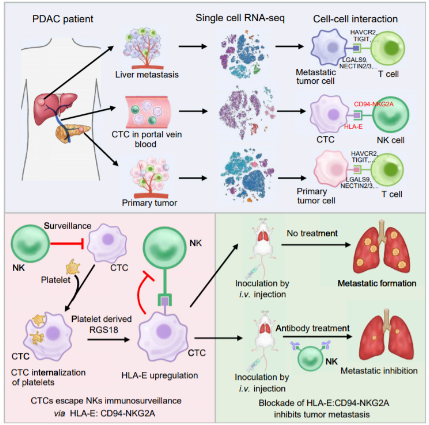
在“Immune checkpoint HLA-E:CD94-NKG2A mediates evasion of circulating tumor cells from NK cell surveillance”一文中,研究人员在单细胞尺度上描述了人胰腺导管腺癌CTCs、原发性和转移性病变的转录组。体外和体内的细胞相互作用分析和功能研究表明,CTCs和自然杀伤细胞(NK)通过免疫检查点分子对HLA-E:CD94-NKG2A相互作用。通过阻断NKG2A或抑制HLA-E表达来破坏这种相互作用可以增强NK介导的体外肿瘤细胞杀伤,并在体内防止肿瘤转移。机制研究表明,血小板源性RGS18通过AKT-GSK3β-CREB信号通路促进HLA-E表达,RGS18过表达促进胰腺肿瘤肝转移。 总的来说,该研究观察到CTCs内化血小板而逃避免疫监测。通过吸收血小板,CTCs获得生物功能大分子,包括蛋白质和mRNA。这些分子可能以转录依赖或独立的方式影响受体细胞的信号转导。血小板内化的确切机制有待进一步研究。
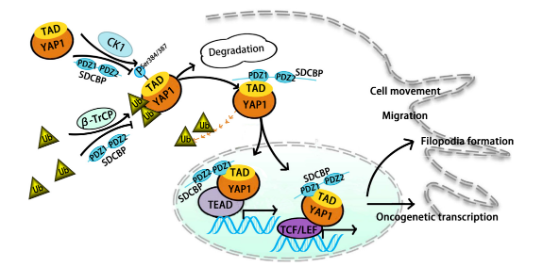
在“SDCBP promotes pancreatic cancer progression by preventing YAP1 from β-TrCP-mediated proteasomal degradation”一文中,研究人员利用本中心多例胰腺癌原位及转移灶单细胞测序,鉴定出了多配体聚糖结合蛋白(SDCBP)与胰腺癌的转移行为显著相关。 在机制上,SDCBP抑制CK1δ/ε-介导的YAP-S384/S387磷酸化,进而通过直接与YAP1相互作用抑制β-TrCP介导的YAP1泛素化和蛋白酶体降解。SDCBP主要通过其PDZ1结构域与YAP1的TAD结构域相互作用。临床前KPC小鼠队列研究表明,吡啶硫酮锌(ZnPT)通过抑制SDCBP抑制PDAC肿瘤进展。SDCBP通过阻止YAP1 β-TrCP介导的蛋白酶体降解促进胰腺导管腺癌的增殖和转移。 研究表明,ZnPT可能是一种通过抑制SDCBP来抑制胰腺导管腺癌进展的有前景的治疗策略。
在“Microbiota-derived 3-IAA influences chemotherapy efficacy in pancreatic cancer”一文中,研究团队招募了30名转移性胰腺导管腺癌患者,根据放射反应或者根据无进展生存期和血清肿瘤标志物的减少情况,分为R和NR患者。研究人员分析了R和NR患者以及匹配的定植gnotobiotic小鼠的血清,并使用液相色谱与质谱联用法进行了靶向代谢组学筛选。并进一步通过结合功能丧失和功能获得实验,证实肠道菌群的一种色氨酸代谢物——吲哚-3-乙酸(3-IAA)可能在化疗治疗胰腺导管腺癌(PDAC)的疗效中具有关键作用。 这项研究结果确定了微生物源性代谢物3-IAA是PDAC对化疗反应的关键放大器。当3-IAA和髓过氧化物酶在FIRINOX(伊立替康和奥沙利铂联合亚叶酸)治疗期间以高浓度存在时,ROS的积累增加,癌细胞的应激适应受损,最终导致PDAC细胞的增殖减少。这些数据为启动临床试验奠定了早期前提,有望通过直接治疗或饮食干预提高化疗期间3-IAA的血清浓度,最终提高PDAC患者的生存率。
在“Ornithine aminotransferase supports polyamine synthesis in pancreatic cancer”一文中,研究人员首先通过代谢示踪法追踪谷氨酰胺,确认了胰腺导管腺癌(PDA)细胞中谷氨酰胺是鸟氨酸的主要来源。接下来研究人员通过体内实验验证了这一发现。作者用p48-Cre-LSL-KrasG12D p53 fl/fl(iKrasG12D)和非肿瘤对照组(iKras WT)进行对比示踪,发现相较于正常胰腺,15-N谷氨酰胺衍生的鸟氨酸在PDA中显著升高。机制研究进一步显示,这种依赖性与PDA肿瘤微环境中的精氨酸耗竭相关,并由突变的KRAS驱动。 研究人员检测了鸟氨酸氨基转移酶(OAT)在组织中的表达情况,发现通过抑制PDA细胞的OAT从而为治疗PDA提供了特异性潜在靶点。体内实验表明抑制OAT可以减缓PDA肿瘤生长。最后研究人员分析了转录组,发现OAT介导了多胺诱导的转录组变化,这也进一步表明OAT是治疗PDA非常具有潜力的靶点。 本研究揭示了PDA对谷氨酰胺衍生鸟氨酸过程的依赖,这种依赖性与正常组织和其他肿瘤类型形成鲜明对比,也为开发毒性小、特异性强的治疗策略提供了潜在的靶点。
既往研究发现炎症与PDAC的发生密切相关。RNA剪接因子在很多肿瘤发生中的机制已被广泛报道,但在胰腺炎和PDAC中的调控机制尚不清楚。该研究团队分析公共的基因表达数据时发现在老鼠胰腺炎模型中,SRSF1 mRNA表达量明显上升;同时发现过表达SRSF1可以促使小鼠发生胰腺炎。此外研究发现在小鼠模型中,相较于单过表达KRASG12D,SRSF1和KRASG12D同时过表达小鼠表现出更加严重的胰腺病变表型。 研究阐明了SRSF1在胰腺炎、PDAC前体病变和肿瘤中的高表达情况,SRSF1通过可变剪接调控白介素1受体1型(IL1R1)基因表达,从而影响MAPK信号通路。这一过程可能诱发胰腺炎并加速KRASG12D介导的PDAC的进展。
此研究发现完全硫代磷酸酯连接修饰增强了原始适配体的稳定性、结合能力和细胞内吞作用,且MMC功能化S-XQ-2d(MFSX)显示出与小分子药物MMC对靶向癌症细胞具有相同水平的细胞毒性,但对非靶向细胞的毒性更低。 完全PS修饰可以为调节适配体和基于适配体的诊断和治疗剂的活性以及促进其临床转化提供一种新的方法。
此研究发现敲除UPP1改变了PDA细胞内代谢组,阻断尿苷衍生的核糖循环,为治疗胰腺癌提供了潜在的药物靶点。
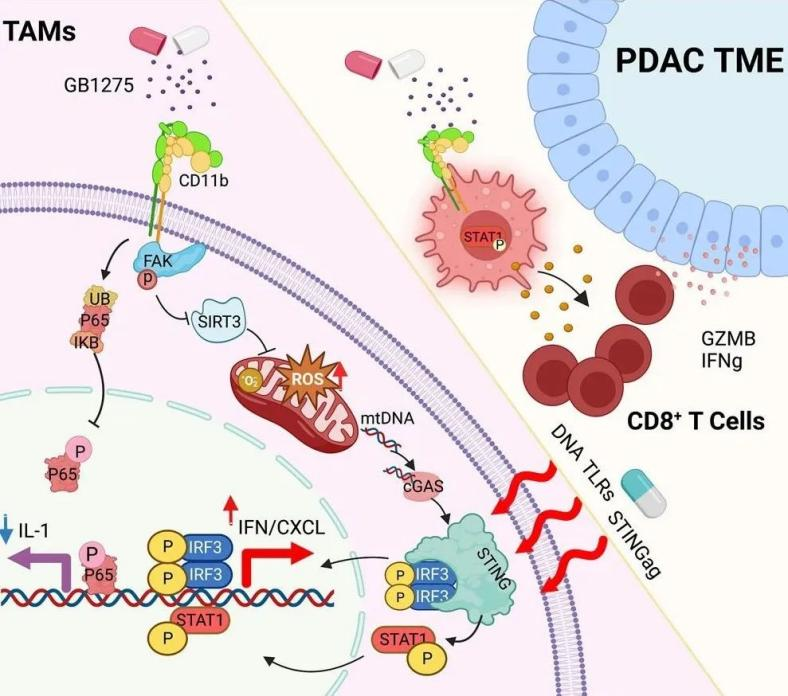
在“Transcriptional control of pancreatic cancer immunosuppression by metabolic enzyme CD73 in a tumor-autonomous and -autocrine manner”一文中,研究人员证明了CD73在胰腺癌免疫抑制中的兼职功能,这是一种以肿瘤代谢、免疫微环境和免疫治疗耐药性之间复杂的串扰为特征的理想模型。在多种胰腺癌模型中观察到CD73特异性药物与免疫检查点阻断相结合的协同作用。 CD73抑制可减少胰腺癌中的肿瘤浸润Treg。发现肿瘤细胞自主CD73促进Treg募集,其中CCL5使用集成的蛋白质组学和转录组学分析被鉴定为CD73的重要下游效应子。CD73 通过肿瘤细胞-自分泌腺苷-Adora2a信号介导的p38-STAT1 轴激活转录上调CCL5,将Treg募集到胰腺肿瘤并引起免疫抑制微环境。 该研究揭示CD73等酶在肿瘤细胞中的非规范作用可能为肿瘤生长的生物学过程提供有价值的信息,并促进开发特定方法来破坏代谢酶用于癌症治疗的兼职功能。
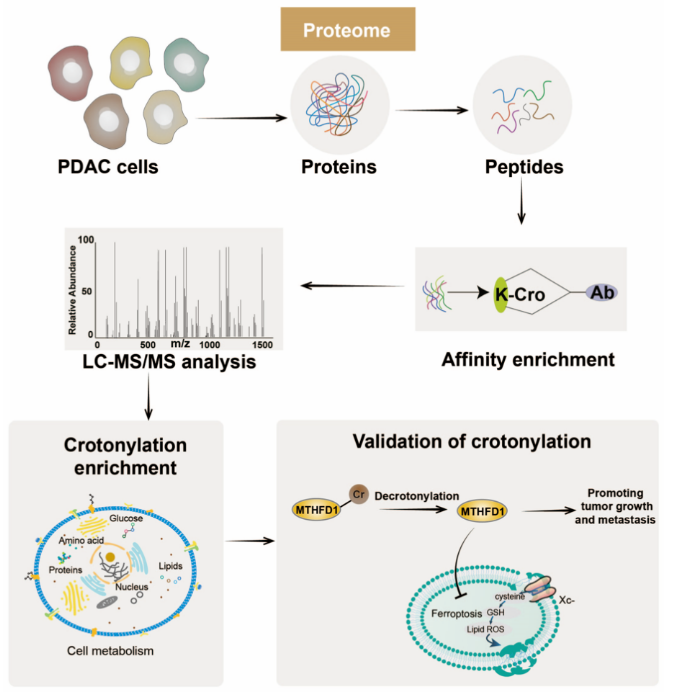
在“Modulation of cellular metabolism by protein crotonylation regulates pancreatic cancer progression”一文中,研究人员利用巴豆酰化修饰组学发现胰腺癌中巴豆酰化修饰蛋白在代谢酶中富集,参与调节糖酵解、三羧酸循环、磷酸戊糖途径、脂肪酸代谢、一碳代谢、线粒体动力学等代谢过程,验证并发现一碳代谢关键酶MTHFD1 Lys354和Lys553位点的低巴豆酰化通过增加肿瘤细胞对铁死亡耐受促进胰腺癌的恶性进展。 这项研究表明代谢酶的动态巴豆酰化参与与肿瘤进展相关的代谢调控,提示巴豆酰化作为一种新的代谢调控机制影响胰腺癌恶性进展。该研究直接将代谢酶巴豆酰化与肿瘤恶性表型联系起来,并证明赖氨酸巴豆酰化可能在调节细胞代谢和癌症恶性进展中发挥重要作用。
小提示:87%用户已下载掌上医讯App,更方便阅读和交流,请扫描二维码直接下载App

(本网站所有内容,凡注明来源为“掌上医讯”,版权均归掌上医讯所有,欢迎转载,转载请注明出处,否则将追究法律责任。凡是本网站注明来源为其他媒体的内容为转载,版权归原作者所有,转载仅作分享,文章观点不作为掌上医讯观点,如有侵权,请及时联系我们,联系电话:0532-67773733)